Regie: Frank Merfort
Ton: Jan Fraune
Sprecherin: Bettina Kurth
Sprecher: Jan Andreesen
Voiceover: Romanus Fuhrmann, Gilles Chevalier, Barbara Becker, Dirk Müller, Martin Mair
Redaktion: Jana Wuttke
Wettlauf im Kampf gegen kommende Pandemien
27:12 Minuten
Von Benno Wenz und Gabi Schlag · 22.07.2021
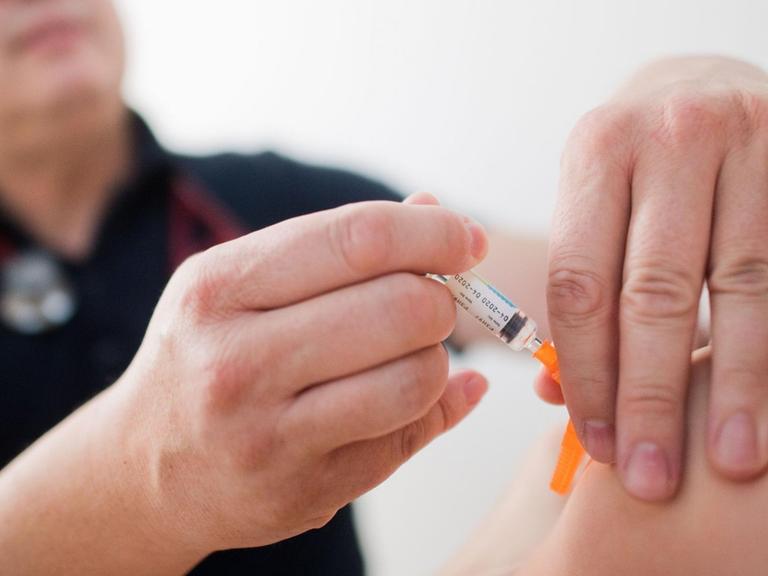
Ein universeller Grippeimpfstoff, statt jedes Jahr ein neuer: Dieses Ziel verfolgen Forschende weltweit. Dabei setzen sie auf unterschiedliche erfolgversprechende Strategien – die auch gegen andere Virenfamilien eingesetzt werden könnten.
Jedes Jahr versucht die Weltgesundheitsorganisation WHO zu prognostizieren, welcher Grippestamm virulent sein wird. Auf Basis dieser Prognose wird der Impfstoff produziert. Das größte Problem: Die Impfstoffe müssen ständig an die neuen Varianten angepasst werden.
Für die Produktion des Serums beobachtet die WHO die hauptsächlich zirkulierenden Viren und gibt im Februar eine Empfehlung für den Herbst ab, gegen welche Influenzavarianten ein Serum produziert werden sollte. Im April beginnt die Impfstoffproduktion.
Da Grippeviren ständig mutieren, kann es passieren, dass sie sich in dem halben Jahr zwischen der WHO-Empfehlung und der Fertigstellung des Impfstoffs schon wieder verändert haben. Dann bietet die Grippeimpfung keinen 100-prozentigen Schutz mehr.
Große Hoffnung Universalimpfstoff
In solchen Fällen ist der für die kommende Saison vorbereitete Impfstoff weniger wirkungsvoll als erhofft. Die Alternative und lebensrettende Möglichkeit: ein Universalimpfstoff.
Martin Friede ist WHO-Experte für Forschung und Entwicklung von Impfstoffen.
"Der heilige Gral der Impfstoffgemeinschaft ist derzeit die Entwicklung eines sogenannten universellen Influenzaimpfstoffs", sagt er. "Im Moment müssen wir jedes Mal, wenn das Influenzavirus mutiert, einen neuen Influenzaimpfstoff herstellen, und die Menschen müssen gegen diesen neuen Influenzastamm geimpft werden. Aber theoretisch ist es möglich, dass wir einen Impfstoff herstellen, der gegen alle Grippestämme schützt.
Auch im Falle einer Pandemie würde ein solcher Impfstoff gegen den Influenza-Pandemiestamm wirken, das ist derzeit nicht der Fall. Sollte ein solcher Impfstoff hergestellt werden, würde das Risiko einer zukünftigen Influenzapandemie signifikant reduziert. Menschen, die bereits geimpft sind, wären nicht gefährdet. Und Länder, die den Impfstoff noch nicht verwenden, könnten rasch Zugang erhalten."
Deshalb suchen einige Wissenschaftler weltweit nach einem solchen universellen Influenzaimpfstoff, denn viele Experten sind der Meinung, dass die nächste Pandemie eine Influenzapandemie sein wird. Und dass diese nicht mehr lange auf sich warten lassen könnte.
Joachim Hombach ist Experte für Impfpolitik bei der WHO.
"Man kann nicht davon ausgehen, dass, wenn man eine Pandemie überstanden hat, man jetzt eine längere Periode sozusagen Ruhe hat", warnt er. "Es sind Einzelereignisse, die immer wieder auftauchen können und möglicherweise auch in zeitlich größerer Nähe."
Wie heftig wird die nächste Pandemie?
Für den Impfstoffexperten Martin Friede ändert die aktuelle Coronapandemie nichts an der Tatsache, dass weitere Pandemien in Kürze anstehen könnten.
"So könnte eine zukünftige Pandemie vor allem viel schlimmer sein als die Covid-19-Pandemie, die derzeit stattfindet", sagt er. "Die Covid-19-Pandemie ist schlimm, aber im Moment ist sie fast nirgends so schlimm wie die sogenannte Spanische Grippe von 1918."
Vor ungefähr zehn Jahren haben der Virologe Peter Palese und sein Team von der Icahn School of Medicine at Mount Sinai im Staat New York den Erreger der Spanischen Grippe von 1918 nachgebaut. Ein umstrittenes Unterfangen, doch Palese und sein Team haben viel dabei gelernt.
Es war das virulenteste menschliche Grippevirus, das Peter Palese jemals gesehen hat, und das will etwas heißen für jemanden, der 4000 Grippeviren in seinen Giftschränken unter Verschluss hält.
Die gleichbleibenden Virusbestandteile im Blick
"Ich arbeite seit vielen, vielen Jahren, seit mehreren Jahrzehnten an Grippeviren", erzählt Peter Palese. "Aber die Fortschritte in der Molekularbiologie sind erst in den letzten zehn Jahren wirklich verfügbar geworden, und sie passierten mit so enormer Geschwindigkeit, dass es erst seitdem möglich war, über einen universellen Influenzavirus-Impfstoff überhaupt nachzudenken, geschweige denn einen zu bekommen."
Man müsste einen Impfstoff entwickeln, der sich nicht gegen die Bestandteile der Viren richtet, die sich durch Mutation ständig verändern, sondern gegen die, die bei allen Influenzaviren immer gleichbleiben – dachten sich Peter Palese und sein Team.
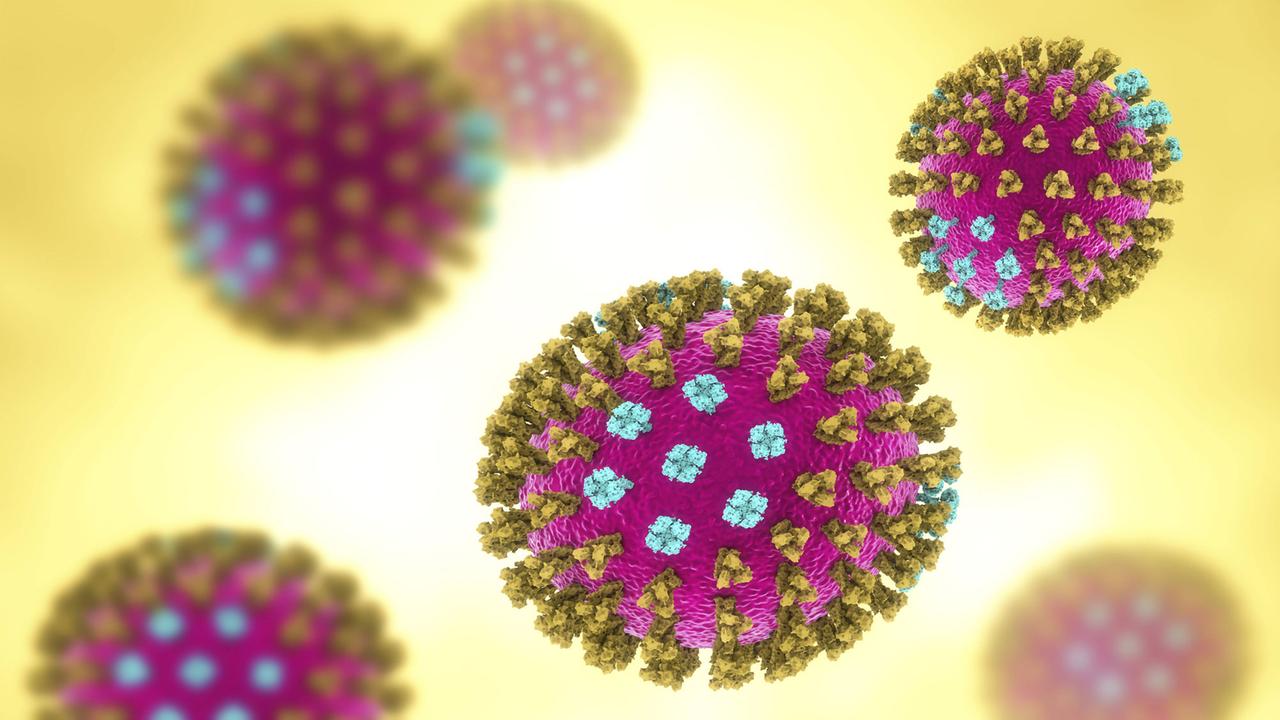
Grippevirus als 3D-Illustration: Die Stacheln sind das, was unser Immunsystem sieht, erklärt Peter Palese.© imago / Science Photo Library
Peter Palese, in Österreich geboren, ist Leiter der Abteilung für Mikrobiologie und forscht bereits sein ganzes Leben an Influenza. Er hofft, dass ihm und seinem Team ein wichtiger Schritt gelungen ist, um einen universellen Impfstoff zu entwickeln.
"Da ist also das Virus, das wie ein Fußball aussieht", erklärt er. "Und es gibt Stacheln auf der Außenseite. Und diese Stacheln sind das, was unser Immunsystem sieht. Und das ist es, was sich wirklich ändert. So haben wir die Außenseite des Virus, die sich ständig verändert, alle zwei oder drei Jahre, so dass wir uns wieder neu infizieren können. Bei diesen Stacheln ist jedoch nur die Spitze relevant für das Immunsystem. Und die Bereiche, die näher an der Oberfläche des Virus sind, was wir als Stiel bezeichnen, die ändern sich nicht, sondern nur die Röschen darüber. Indem wir versuchen, den Stiel zu finden, hoffen wir, dass wir jede Influenzainfektion verhindern können."
Am Stiel und nicht am Röschen ansetzen
Peter Palese und Team entwickelten einen Virusstamm im Labor, der die Immunabwehr umlenkt. Dazu setzten die Forscher verschiedene im Labor designte Stiel-Brokkoliröschen-Kombinationen ein, bei denen der Stiel immer gleichbleibt und die Röschen sich ständig ändern.
So wird das Immunsystem darauf trainiert, den Stiel als das Gefährliche zu erkennen. Das heißt, die Immunantwort konzentriert sich nicht auf die Proteine, die mutieren können, sondern auf die stabilen Teile des Virus. Auf diese Weise sollte der Körper immer erkennen, dass es sich um einen Influenzaerreger handelt.
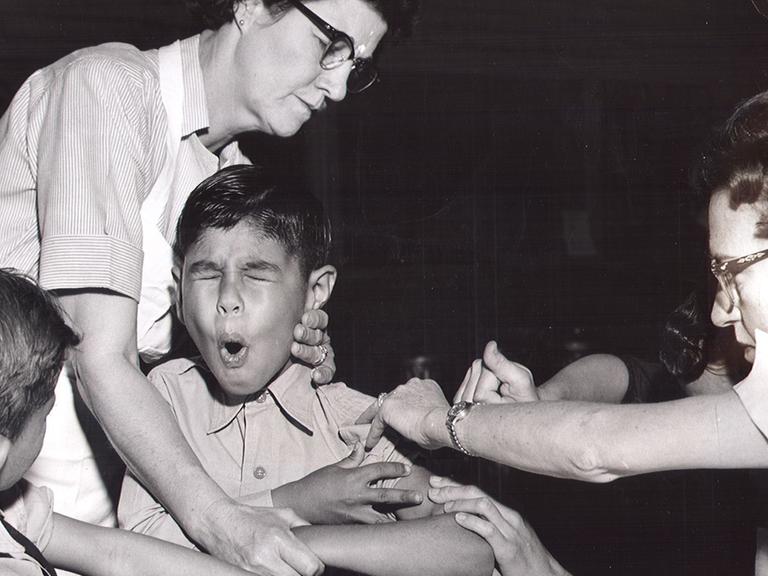
Impfungen sind ein medizinischer Segen, sie retten Leben. Viele Krankheitserreger können so in Schach gehalten werden. Für einen lebenslangen Schutz gegen Masern oder Röteln reichen zwei Stiche. 95 Prozent der Menschen können damit gegen die hochansteckenden Viren immunisiert werden.
Um Infektionen wie FSME oder Keuchhusten in den Griff zu bekommen, braucht es alle fünf oder zehn Jahre Auffrischungsimpfungen.
Influenzaviren wandern und verändern sich
Der Kampf gegen Grippeviren gestaltet sich hingegen deutlich schwieriger: Die Grippeimpfung muss jedes Jahr erneut verabreicht werden. Ihre Schutzwirkung liegt im Schnitt bei etwa 60 Prozent. Während einer starken Influenzasaison erkranken ohne Impfung zehn von 100 Menschen.
Influenzaviren wandern von einem zum anderen. Dabei verändern sie sich. Das ist die große Hürde bei der Suche nach einem Universalimpfstoff.
Influenza ist eine Zoonose. Zoonosen sind Krankheiten, die vom Tier auf den Menschen überspringen, so die vereinfachte Definition. Es gibt mehr als 200 solcher Krankheiten. Die neueste ist Covid-19, eine der tödlichsten ist AIDS.
Influenzaviren stammen ursprünglich von Wasservögeln, existieren aber auch in anderem Geflügel, in Schweinen oder Fledermäusen und können von all diesen verschiedenen Tieren auch auf den Menschen überspringen.
Wechsel von Tier auf Mensch birgt große Gefahr
Professor Martin Schwemmle vom Institut für Virologie des Universitätsklinikums Freiburg erforscht ein Influenzavirus, das kürzlich in Fledermäusen entdeckt worden ist. Schwemmle und sein Team haben herausgefunden, dass H18N11 nicht Körperzellen befällt, sondern ausschließlich Zellen des Immunsystems.
Das zeigt, wie außerordentlich wandlungsfähig Influenzaviren sind – und wie gefährlich sie für die Menschheit auch in Zukunft bleiben werden.
"In der Regel ist es so, dass wenn es eine echte Zoonose ist", sagt Martin Schwemmle, "da gibt es keine Antikörper, und das Immunsystem muss erst lernen, was der neue Erreger wirklich tatsächlich ist. Wir haben keine Antikörper, haben keine T-Zellen, nichts da, was eigentlich den neuen Erreger erkennt und zum Teil neutralisieren kann."

Martin Schwemmle erforscht ein Influenzavirus, das kürzlich in Fledermäusen entdeckt worden ist.© picture alliance / dpa / Patrick Pleul
Viren sind infektiöse Partikel, die aus einer Nukleinsäure - DNA oder RNA - und einer Proteinhülle bestehen. Da sie sich aus eigener Kraft nicht vermehren können, pflanzen sie sich fort, indem sie ihr Erbgut in die Zellen eines Wirts schleusen, zum Beispiel eines Nagetiers. Sie manipulieren die Wirtszellen so, dass diese weitere Viren produzieren.
Wenn die Artenschranke überwunden ist
Viren tragen an ihrer Oberfläche bestimmte Strukturen, die wie ein Schlüssel in das Schloss der Zelle passen. Nur die Viren mit dem passenden Schlüssel können in die Nagetierzellen eindringen.
Die neu entstandenen Viren verändern sich, sie mutieren. Die meisten Mutationen schaden dem Erreger selbst, aber in einigen Fällen führen sie auch zu neuen Anpassungen. Dabei kann zufällig ein Schlüssel entstehen, der bei einer Übertragung auf den Menschen zum Schloss einer menschlichen Zelle passt.
Damit ist die Artenschranke überwunden. Eine Tierinfektion wurde auf den Menschen übertragen. Auf dieselbe Art kann der Erreger manchmal wieder zum Tier zurückspringen. So zum Beispiel bei der Schweinegrippe 2009.
"Das war ein Virus, das schlussendlich aus dem Schwein kam", sagt Martin Schwemmle. "Aber man weiß mittlerweile, das Influenzavirus hat acht Genome. Und dass diese Genome zwischen den Influenzavirus-Stämmen ausgetauscht werden können. Und dieser Austausch hat schon früher stattgefunden."
Von menschlichen Grippeviren existieren gleich mehrere Stämme aus vier unterschiedlichen Gruppen. Mediziner unterscheiden sie anhand des Hämagglutinins, kurz H, und der Neuraminidase, kurz N. Bislang haben Forscher 16 verschiedene H-Proteine und neun N-Proteine entdeckt. Nach deren Kombination werden auch die Influenza-A-Viren genannt.
Schwein von Mensch und Vögeln infiziert
Ursprünglich hat der Mensch das Schwein mit humanen Influenzaviren infiziert, und dann kamen noch Infektionen mit Vogelinfluenza dazu. Diese Viren mischten sich dann mit den Schweine-Influenzaviren, und aus dieser Mixtur im Schwein ist 2009 eine Konstellation entstanden, in der Viren vom Typ H1N1 es geschafft haben, wieder auf den Menschen überzuspringen und dann als "Schweinegrippe" um die Welt zu gehen.
"Lustigerweise ist es so", sagt Martin Schwemmle. "Das ging auf den Menschen über und hat sich dann als Pandemie im Menschen durchgesetzt. Zum Glück war diese 2009-Pandemie eigentlich nicht so verheerend wie die 1918-Pandemie. Aber auch diese Viren vom Menschen gingen wieder zurück ins Schwein. Das Schwein wurde auch vom Menschen infiziert. Und jetzt sieht man im Schwein diese humanen Influenzaviren zirkulieren, die sich wieder mit den Schweineviren austauschen können, und da wird wieder heftig gemischt. Und da kann man dann warten, was das nächste Virus dann wäre."
Austausch von Erbgut, ständig neue Eigenschaften
Wie kaum ein anderes Virus hat gerade Influenza die Fähigkeit, durch Austausch von Erbgut untereinander immer wieder neue Eigenschaften zu erzeugen – wie zum Beispiel die Eigenschaft, sich von Mensch zu Mensch weiterzuverbreiten. Genau das macht es so gefährlich.
Peter Palese möchte einen Impfstoff herstellen, mit dem der menschliche Körper tatsächlich dauerhaft wehrhafte Antikörper produziert.
"Wir definieren einen universellen Influenzaimpfstoff als einen, der gegen alle Stämme schützt", erklärt er. "Auch gegen diejenigen, die wir noch nicht kennen, weil alle diese unveränderlichen Teile haben müssen, um funktionieren zu können. Wir glauben, dass dieser Impfstoff gegen alle Stämme wirksam ist: Die alten, was natürlich nichts mehr nützt, aber vor allem gegen die neuen. Wir haben bereits den ersten klinischen Versuch. Das, was als Phase-I-Studie bezeichnet wird, ist im Gange. Und wir hoffen, dass dies weiterverfolgt wird, dass wir in Phase II und Phase III gelangen. Aber wenn es nicht so einen Anschub wie bei COVID-19 gibt, wo der Zeitplan verkürzt ist, kann es Jahre dauern, bis dies wirklich etwas für den Menschen ist."
Die Impfstoffentwicklung beginnt im Labor, wird am Tiermodell getestet und muss dann drei klinische Phasen durchlaufen. Sollten die Phase-II-Studien erfolgreich sein, muss der Impfstoff noch an einer großen Anzahl von Menschen geprüft werden, bis er zugelassen wird.
Mindestens 50.000 Probanden müssen es sein, Kostenpunkt 200 Millionen Dollar. Es sind also noch einige Hürden zu nehmen, bis die Impfung tatsächlich auf den Markt kommt.
Zwölf Millionen Belohnung von Bill Gates
Wer einen solchen universellen Influenzaimpfstoff als erster findet, würde mit zwölf Millionen Dollar belohnt werden: Von Bill Gates, der das Projekt "Universeller Grippe-Impfstoff" zu einer "Grand Challenge" erklärt hat und entsprechend unterstützt.
"Schauen wir uns eine Computersimulation von einem Virus an, das sich durch die Luft verbreitet, wie die Spanische Grippe von 1918", sagt er. "Es würde sich sehr, sehr schnell verbreiten. In einer solchen Epidemie würden über 30 Millionen Menschen sterben. Das ist ein ernstes Problem, und wir sollten uns Sorgen machen."
Weltweit gibt es zurzeit eine ganze Reihe von Forscherteams, die an einem universellen Influenzaimpfstoff arbeiten. Einen wichtigen Meilenstein hat SEEK geschafft, ein internationales Biotech-Unternehmen mit Hauptsitz in London. Sein universeller Influenzaimpfstoff "FLU-v" richtet sich gleich gegen vier Virusbestandteile, die normalerweise nicht mutieren.
Olga Pleguezuelos ist die Forschungsleiterin. Während Peter Palese in New York Antikörper entwickelt, die das Virus angreifen, sobald es im Körper zirkuliert, gelangt es bei SEEK in die Zelle, infiziert die Zelle, die infizierte Zelle erkennt das Virus und ruft T-Zellen herbei, die die befallenen Zellen samt Viren "auffressen", also eliminieren.
T-Zellen-Antwort als universelle Impfstrategie
Olga Pleguezuelos erklärt: "Die Art der Immunantwort, die wir aktivieren wollen, ist eine T-Zellantwort. Und diese Zellen erkennen im Grunde die Zellen, die in Ihrem Körper infiziert sind. Und sie zerstören sie. Dadurch verhindern sie, dass sich die Infektion ausbreitet. Dann versuchen viele Impfstoffe da draußen, immer noch die äußeren Teile des Virus anzugreifen. Die Proteine, die wir anvisieren, sind innerhalb des Virus. Wir versuchen nicht, Antikörperreaktionen zu induzieren. Wir versuchen, diese zellulären T-Zell-Reaktionen zu induzieren. Und deshalb ist es ein anderer Mechanismus."
Gerade haben Olga und ihr Team erfolgreich die Phase-II-Doppelblindstudie mit 175 gesunden Teilnehmern absolviert. Jetzt muss eine weitere Runde mit 10.000 Teilnehmern folgen.
Sollte sich dieser Weg als erfolgreich herausstellen, könnte er sich möglicherweise auf andere Virusfamilien übertragen lassen. Und es könnte sich daraus eine neue Art entwickeln, wie die Menschheit Viren bekämpft: Nicht mehr nur ganz spezifisch gegen einen ganz bestimmten Erreger, sondern gegen Familien oder Gruppen von Viren.
Ansatz auch für Medikamente nutzbar machen
Impfstoffe würden einen viel breiteren Schutz bieten als das heute möglich ist. Noch stärker könnte dieser Ansatz bei Wirkstoffen in neuartigen Medikamenten zum Tragen kommen.
Seit langem gibt es Breitspektrum-Antibiotika, die zugleich gegen mehrere bakterielle Erreger wirken. Von solchen Wirkstoffen können Virologen bislang nur träumen. Denn es fehlen Präparate, die gleichzeitig gegen mehrere virale Erreger wirken. Sebastian Ulbert vom Fraunhofer Institut für Zelltherapie und Immunologie in Leipzig ist mit seinem Team auf der Suche nach Wirkstoffen gegen Flaviviren.
"Wir beschäftigen uns in unserer Abteilung schon seit vielen Jahren mit den sogenannten Flaviviren", erklärt er. "Und hier beschäftigen wir uns momentan mit einem Projekt, wo wir versuchen, Wirkstoffe zu finden, die gegen mehrere Flaviviren einsetzbar sind, sodass man mit einem einzelnen Wirkstoff im Idealfall verschiedene Infektionen bekämpfen kann, die durch Flaviviren ausgelöst werden."
Flaviviren sind sehr kleine Viren, die RNA als genetische Information tragen. Die meisten der in den letzten Jahrzenten neu aufgetretenen gefährlichen Viren wie Ebola, Corona oder Influenza sind RNA-Viren. Während die doppelsträngige DNA das Erbgut des Menschen - und der meisten Lebewesen - speichert und nicht abgibt, sorgt die RNA unter anderem dafür, dass genetische Informationen abgelesen werden: Um damit zum Beispiel neue Zellen aufzubauen.
RNA-Viren mit hoher Mutationsrate
Die Enzyme, die für die Vervielfältigung der genetischen Information zuständig sind, produzieren viele Kopierfehler. So kommt es zur hohen Mutationsrate, die die Viren so schwer bekämpfen lässt.
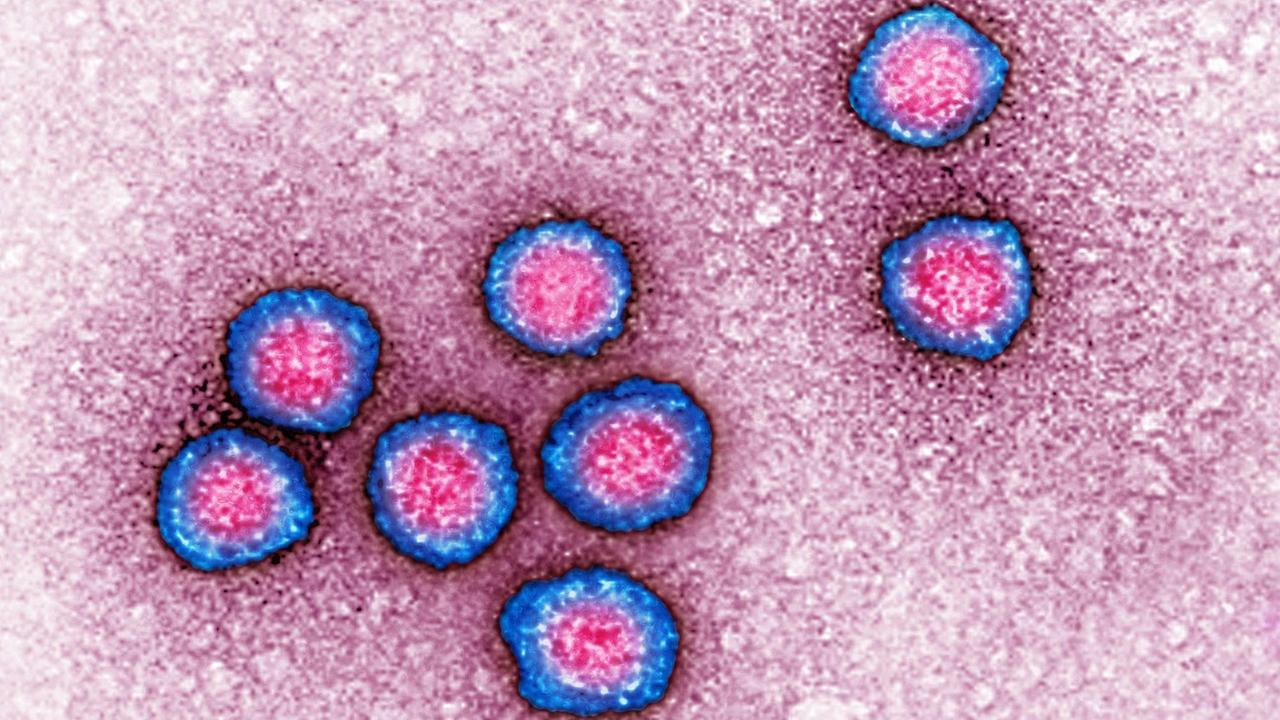
Visualisierung per Elektronenmikroskop: Flaviviren sind sehr klein und tragen RNA als genetische Information.© icture alliance / BSIP / James Cavallini
Flaviviren werden zumeist durch Stechmücken übertragen und lösen jede Menge ganz unterschiedlicher Infektionskrankheiten aus. Zika, Dengue-Fieber West-Nil-Fieber, Gelbfieber und die durch Zecken übertragene FSME-Krankheit, die auch bei uns heimisch ist.
Wie ist es möglich, dass so viele und so unterschiedliche Krankheiten durch dieselbe Familie von Viren verursacht werden?
"Ein Virus braucht ja, um in eine Wirtszelle einzudringen, in der Regel einen Rezeptor", sagt Sebastian Ulbert. "Und es gibt Viren, die sind da sehr spezifisch. Die haben einen bestimmten Rezeptor auf der Wirtszelle. Und es gibt Viren, die können ganz viele verschiedene Rezeptoren auf der Zelloberfläche benutzen, um in die Zellen einzudringen. Und nun ist es so, dass diese Rezeptoren nicht immer auf einem Zelltyp drauf sitzen müssen. Es gibt Zelltypen, die haben mehr vielleicht von dem einen Rezeptoren, weniger von dem anderen und so weiter. So unterscheiden sich die Zielzellen von den Viren.
Und wenn man jetzt zum Beispiel das West-Nil-Virus nimmt, das geht sehr schnell in das zentrale Nervensystem. Die Rezeptoren für das West-Nil-Virus sind besonders stark ausgeprägt auf Nervenzellen. Und das ist bei anderen Flavivieren, wie zum Beispiel Dengue, eben nicht so. Die bleiben mehr im zirkulierenden System, im Kreislaufsystem. Und so unterscheiden sich die Wirtszellen, und letzten Endes unterscheidet sich dadurch der Weg, den das Virus im infizierten Menschen geht und letzten Endes auch die Symptomatik der Infektion."
Der Wirkstoff, den Sebastian Ulbert und sein Team gefunden haben, richtet sich nicht gegen einen Teil des Virus selbst, sondern gegen den Mechanismus, der in der infizierten Zelle abläuft.
Abläufe in der Zelle biomechanisch blockieren
"Der Wirkstoff wird dann in der Zelle bestimmte Prozesse blockieren, die das Virus für seine Vermehrung braucht", erklärt er. "Es hat also überhaupt nichts mit irgendwelchen Antikörpern zu tun oder mit einer Immunantwort. Es ist eine rein biochemische Blockade von einem Stoffwechselweg, der gerade in einer infizierten Zelle passiert."
Dass Wissenschaftler eine Art Breitbandimpf- oder Wirkstoff gegen Viren entwickeln wollen, ist neu. Bisher musste jeder Virustyp spezifisch bekämpft werden.
Das versuchen Peter Daszak und Dennis Carroll im weltumspannenden Global Virome Project. Die Wissenschaftler möchten einen Atlas aller potentiell gefährlichen Viren erstellen. Dazu arbeiten sie eng mit Forschungseinheiten zusammen, die in die entlegensten Gegenden vordringen, um dort Proben von Tieren zu nehmen, die Viren in sich tragen: zum Beispiel Fledermäuse, Nager oder Affen.
So entstehen regelrechte Virenkataloge, auf deren Basis man im Falle eines Ausbruchs schnell den Übertragungsweg ermitteln kann. Daszak und Carroll wollen für ihr Global Virome Project dieses Virenarchiv noch um ein Vielfaches erweitern und systematisieren. Damit die Welt auf die nächste Pandemie besser vorbereitet ist.
"Solange wir blind sind, wie diese zukünftigen Bedrohungen aussehen, werden wir immer erst reagieren, wenn sie auftauchen.", sagt Dennis Caroll. "Wir können mit der Entwicklung detaillierter viraler Hotspot-Karten beginnen. Es gibt bestimmte Orte potenziell gefährlicher Viren, die in Wildtieren zirkulieren. Tiere, die eine hochfrequente Interaktion mit Menschen haben. Und das Verständnis der Verhaltensweisen, die hinter diesen hochfrequenten Interaktionen stehen, ermöglicht es uns, die Spillover-Ereignisse zu verhindern."
Was bringt ein riesiger Virenkatalog?
Viele Wissenschaftler halten dieses Vorgehen für nicht praktikabel. Auch, weil Viren sich ständig verändern und die Impfstoffe rasch wieder ihre Wirksamkeit verlieren. Allein wenn man sich die Säugetiere anschaut, gibt es 380 000 verschiedene Viren.
"Man kann nicht gegen jeden möglichen Erreger einen eigenen Impfstoff produzieren", sagt Alice McHardy. "Ich glaube, das wäre einfach nicht machbar. Es gibt unheimlich viele verschiedene Viren. Die Diversität ist so hoch, und sie können sich so schnell verändern. Die Variante ist nicht machbar, denke ich, dass man jetzt einfach so einen Katalog macht und sagt: Wir bereiten jetzt hier eine Million verschiedene Impfstoffe vor. Aber man könnte eben solche breiter wirkenden Impfstoffe schaffen. Das ist ein vielversprechender Ansatz, dass man versucht, breiter wirkende Impfstoffe zu entwickeln, die dann idealerweise vor Erreger-Gruppen schützen. In die Richtung könnte es Sinn machen, wirklich in die Forschung zu investieren.
Die Bioinformatikerin Alice McHardy vom Helmholtz-Zentrum für Infektionsforschung in Braunschweig leitet ein Projekt, das direkt von der Bill und Melinda Gates Stiftung im Rahmen ihrer "Grand Challenge"–Kampagne zur Schaffung eines universellen Influenzaimpfstoffs unterstützt wird.
McHardy setzt Verfahren der Bioinformatik ein, um ein so genanntes Neuraminidase-Antigen zu entwickeln. Neuraminidase ist eines der beiden charakteristischen Enzyme, die das Influenzavirus benutzt, um sich zu vermehren: Hämagglutinin, um in Zellen eindringen zu können, und Neuraminidase, um die neuen Viren wieder aus der Zelle auszuschleusen.
Als Teil eines Impfstoffs soll das künstliche Enzym das Immunsystem darauf trainieren, genau diesen Bestandteil des Virus zu erkennen und zu bekämpfen.
Wertvolle Zeit seit SARS-1 verloren
Rolf Hilgenfeld forscht bereits seit den 1990er-Jahren am Coronavirus, und hätte man dies gefördert und seine Forschung finanziell unterstützt, hätte man heute vielleicht ein Medikament gegen Covid-19.
Als ehemaliger Forscher für die Industrie argumentiert der Grundlagenforscher mit ökonomischen Argumenten.
"Wir haben seit 2003 schon an SARS-1 gearbeitet und da die ersten Strukturen von Coronavirus-Proteinen aufgeklärt", erzählt er. "Die ersten Wirkstoffe vorgeschlagen. Das hat niemanden so richtig interessiert. Nach zwei Jahren nach dem Ausbruch war das Interesse wieder minimal. Ich will auch der Pharmaindustrie da keinen Vorwurf machen. Wenn Sie nur 8000 SARS-Einzelfälle haben und 2500 MERS-Fälle, ist das kein Markt, und die Pharmafirma ist so aufgestellt, dass sie den Aktionären Rechenschaft schuldig sind und sie können nicht investieren in eine Krankheit, die keinen Markt darstellt.

Laborproben in einem Tablett: "Das hat niemanden so richtig interessiert", sagt Rolf Hilgenberg über die Forschung nach SARS-1.© imago images / Westend61
Doch jenseits des Marktes sieht Rolf Hilgenfeld auch den Staat in der Verantwortung.
"Aus der Rückschau könnte ich sagen: Wenn die Bundesregierung nach SARS-1 eine Milliarde Euro in die Hand genommen hätte, um ein Institut, ein staatliches Institut für antivirale Chemotherapie zu gründen, müssten wir jetzt nicht Milliarden und Abermilliarden in die Hand nehmen, um die Wirtschaft wieder halbwegs anzukurbeln. Dann hätten wir Medikamente gehabt. 17 Jahre sind seitdem vergangen. Das ist genügend Zeit, um ein Medikament zu entwickeln."
Einen Grund dafür, dass das nicht passiert ist, sieht Dennis Caroll darin, dass alle Netzwerke, die vorher hervorragend zusammengearbeitet haben, zugunsten nationaler Interessen aufgelöst wurden.
"Was wir als Reaktion auf das Covid-19-Virus gesehen haben, war ein absoluter Zusammenbruch der langjährigen globalen Netzwerke und Partnerschaften, die die Grundlage dafür waren, dass Länder über ihre Grenzen hinweg zusammenarbeiten konnten, um auf solche globalen Bedrohungen zu reagieren", sagt sie. "Und ich denke, dies ist sicherlich eine Folge des Aufstiegs des Populismus und des Nationalismus."
Virenforschung als Teil staatlicher Daseinsvorsorge
Vor dem Hintergrund von SARS und MERS ließ die Bundesregierung 2012 unter Federführung des Robert Koch-Instituts das Worst-Case-Szenario für eine Pandemie in Deutschland simulieren: "Modi-SARS". In dieser Simulation verbreitet sich ein aus Asien eingeschlepptes Virus unkontrolliert in Deutschland und führt in der Spitze zu bis zu vier Millionen gleichzeitig Erkrankten.
Obwohl diese Riskoanalyse ein so genanntes Maximalszenario durch einen fiktiven Erreger darstellt, steigt mit zunehmender Vernichtung von Ökosystemen und Biodiversität auch die reale Wahrscheinlichkeit von Pandemien.
Darauf zu reagieren, sieht Rolf Hilgenfeld als Teil einer staatlichen Daseinsfürsorge.
"Wir sollten alle RNA-Viren untersuchen, die uns bekannt sind", fordert er. "Wir sollten unbekannte aufspüren, sequenzieren. Wir sollten die Strukturen aufklären von einigen Schlüsselenzymen dieser RNA-Viren und für jedes Schlüsselenzym, für jede Virusfamilie einen Wirkstoff entwickeln, den wir im Regal stehen haben. Und wenn es so weit ist, dann wird der schnell in die Testung gebracht und in großen Mengen produziert, sodass wir Jahre an Grundlagenforschung einsparen könnten. Das kostet natürlich viel Geld und ist eine staatliche Aufgabe. Das ist Teil der staatlichen Daseinsfürsorge."